高中的化学是理综里面有点文综性质的科目,小伙伴们在化学的过程中,不要埋头刷题,要先将知识点都弄懂才行。下面是为大家的高中化学必备的知识,一起来了解一下~
1、共价键类型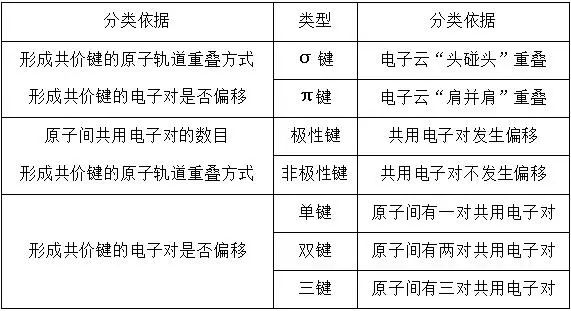
2、分子的立体构型与性质
(1)价层电子对互斥模型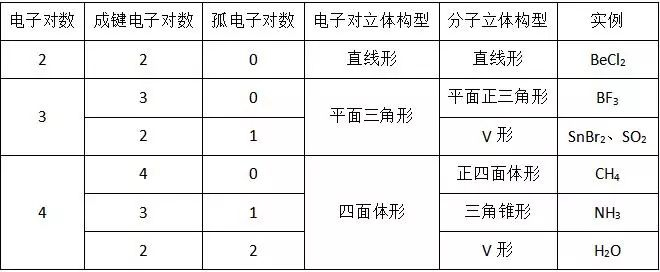
注意:
运用价层电子对互斥模型可预测分子或离子的立体结构,但要注意判断其价层电子对数,对ABm型分子或离子,其价层电子对数的判断方法为:n=(中心原子的价电子数+每个配位原子提供的价电子数×m)/2
(2)杂化轨道类型与分子立体构型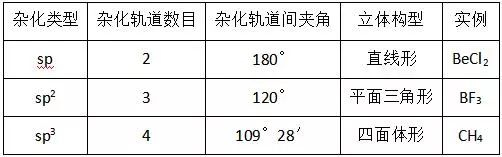
(3)分子的极性:分子中正电中心和负电中心重合的分子是非极性分子,分子中正电中心和负电中心不重合的分子是极性分子。
3、配合物的组成、结构、性质
(1)概念:由金属离子(或原子)与某些分子或离子(称为配体)以配位键结合而成的化合物。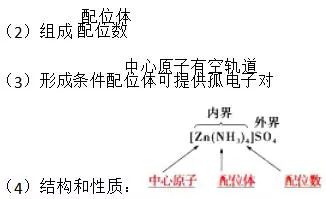
4、分子间作用力与物质性质:分子间作用力最常见的是范德华力和氢键,其中范德华力<氢键<化学键。
(1)范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点越高,硬度越大。一般来说,结构和组成相似的物质,随着相对分子质量的增加,范德华力逐渐增大,分子的极性越大,范德华力也越大。
(2)氢键:已经与电负性很强的原子形成共价键的氢原子(该氢原子几乎为裸露的质子)与另一个分子中电负性很强的原子之间的作用力,称为氢键。表示方法:A—H…B。氢键具有一定的方向性和饱和性。:氢键包括分子内氢键和分子间氢键两种。分子间氢键对物质性质的影响:主要表现为使物质的熔、沸点升高,对电离和溶解度等产生影响。
方法技巧
(1)怎样判断化学键的类型和数目?
①只有两原子的电负性相差不大时,才能形成共用电子对,形成共价键,当两原子的电负性相差很大(大于1.7)时,不会形成共用电子对,这时形成离子键。
②通过物质的结构式,可以快速有效地判断共价键的种类及数目;判断成键方式时,需掌握:共价单键全为σ键,双键中有一个σ键和一个π键,三键中有一个σ键和两个π键。
(2)三点说明:
①s轨道与s轨道重叠形成σ键时,电子不是只在两核间运动,而是电子在两核间出现的概率增大。
②因s轨道是球形的,故s轨道和s轨道形成σ键时,无方向性。两个s轨道只能形成σ键,不能形成π键。
③两个原子间可以只形成σ键,但不能只形成π键。
(3)分子极性判断:分子中的中心原子的最外层电子若全部成键,此分子一般为非极性分子;分子中的中心原子的最外层电子若未全部成键,此分子一般为极性分子。如CH4、BF3、CO2等分子中的中心原子的最外层电子均全部成键,它们都是非极性分子。而H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部成键,它们都是极性分子。
(4)含氧酸酸性比较:同种元素的含氧酸的强弱规律,其酸性具有如下规律:对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
(5)氢键应用要注意:
①有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键。
②一个氢原子只能形成一个氢键,这就是氢键的饱和性。
③分子内氢键基本上不影响物质的性质。
(6)判断分子的中心原子杂化轨道类型的方法
①根据杂化轨道的空间分布构型判断:若杂化轨道在空间的分布为正四面体或三角锥形,则分子的中心原子发生sp3杂化;若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化;若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp杂化。
(2)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。
(3)记住常见的一些典型分子中中心原子的杂化方式。